hay cuelgo esta entrada que habla sobre los materiales metálicos y sus estructuras internas, esta entrada quizás sea un poco técnica, pero no sabia explicarla mejor ya que es difícil hablar sobre algo que no comprendo muy bien, como es el caso de las estructuras atómicas, pero de todo se aprende un poco, empezamos:
1) Tipos de enlaces químicos (definición, tipos, características generales)
En el mundo existen millones de sustancias diferentes, pero solo unos poco elementos químicos que las forman (son los elementos de la tabla periódica).
Entonces... ¿como se forman tantas sustancias si existen tan pocos elementos?, la respuesta es simple, mezclando las, de hecho, muchas veces los propios elementos se juntan solos, ya que por separado son inestables (son inestables porque tienen un numero distinto a 8 electrones en su ultima capa).
Un material se hace estable cuando tiene 8 electrones en su ultimo nivel, y todos los elementos tienden siempre a estar estables, por lo que los átomos de los elementos tienden a adquirir una estructura de 8 electrones en su ultimo nivel, que se le llama capa de valencia, para ello, ceden, cogen o incluso comparten electrones con otros átomos, los cuales pueden ser incluso de distinta naturaleza (esto que acabo de relatar ahora se le llama ley del octeto).
Es esa tendencia de los átomos a unirse a lo que llamamos enlace químico, cuando se forman estos enlaces (en los que dentro de la unión se encuentran varios átomos) dan lugar a moléculas, y estas incluso se pueden unir entre si y formar estructuras multimoleculares (estos enlaces, si están los átomos ordenados en ellos, y están muy "pegadas" entre si forman estructuras cristalinas)
Estos enlaces los hay de muchos tipos, pero yo me centrare en tres, que por así decirlo son los principales, que son: el enlace ionico, el enlace covalente y por ultimo el enlace metálico, los cuales ahora veremos mas detenidamente:
 |
| Esquema de enlaces |
-Enlace ionico: Como ya dije, los elementos se unen entre si para formas las sustancias que tenemos en todo el mundo, cuando un elemento metal se une con un elemento no metal (es decir ceden electrones el uno al otro para tener 8 en la capa de valencia), normalmente, los metales tiene mas de 8 electrones en la ultima capa, por lo que ceden los que le sobran al no metal y este se une al elemento metálico para mantenerse estable y así seguir manteniéndose con 8 electrones.
Un típico enlace ionico seria la sal (cloruro sódico o NaCl), la cual resulta de la unión del sodio con el cloro, en el que el el sodio (metal cede un electrón y el cloro (no metal) le gana.
En este caso hay unas fuertes fuerzas de atracción entre ambos crea un orden de las moléculas y se crea una red cristalina.
 |
| Red cristalina del Cloruro sódico |
Como norma general este tipo de enlaces son bastante fuertes, se disuelven en agua (como ya e dicho la sal es un claro ejemplo), pero no en gasolina y cuando están disueltos conducen muy bien la electricidad, pero si están en estado solido son aislantes tienen puntos de fusión elevados, son sólidos a temperatura ambiente
-Enlace covalente: De entre las muchas sustancias que hay, solamente unas pocas son ionicas, a lo que voy es que debemos pensar entonces como hacer para conseguir estabilizar los iones y formar otros enlaces.
Aquí es donde entran en juego los enlaces covalentes, estos enlaces en vez de ser formados por un metal y un metal, están formados por 2 no metales, que pueden ser iguales o diferentes, o puede ser un no metal con hidrógeno y a demás de eso, se diferencian de los ionicos, en que en vez de ceder y adquirir electrones para tener 8, estos los comparten.
 |
| Enlace covalente, con un electrón compartido |
Existen los enlaces covalentes simples (comparten 1 par de electrones), los dobles(comparten 2 pares de electrones) y los triples (que comparten 3 pares de electrones)
Sus características dependen de si se han creado estructuras cristalinas con ellos, o si solo son moléculas; en el caso de ser estructuras cristalinas (como puede ser el cuarzo), tienen puntos de fusión altos, no conducen la electricidad y son difíciles de disolver.
En el caso de ser moléculas, a temperatura normal y corriente son gases, líquidos (como el agua, que es un enlace covalente, H2O), tienen puntos de fusión y ebullición bajos y por lo general no conducen muy bien la electricidad.
-Enlace metálico: Este enlace se forma de un modo distinto a los demás, y es que ni cede ni comparte electrones, sino que los distribuye por la superficie de una estructura cristalina, a continuación le vemos en mas profundidad.
2) El enlace metálico (en profundidad)
Llega el turno de explicar mas en profundidad el enlace metálico, este es muy distinto a los dos tipos de enlaces que hemos visto hasta ahora: el enlace covalente y el enlace ionico, los metales, aunque no lo veamos, están formados por pequeños cristales, ya que se basa en una estructura cristalina, pero a diferencia de los otros enlaces, este no cede ni comparte electrones, sino que hace una cosa completamente distinta, los libera (solo los electrones de valencia, los de la ultima capa) haciéndose un ion positivo, estos iones positivos (o lo que es lo mismo cationes) se ordenan formando una estructura cristalina y los electrones que han liberado los envuelven como si fueran una nube o una manta por así decirlo.
 |
| Nube electrónica de un enlace metálico |
Estos electrones se pueden mover muy fácilmente, ya que no están casi sujetos a nada, y si recordamos algo de química, tenemos que saber que son los electrones de valencia (los de la ultima capa) los que se mueven en la corriente eléctrica, por eso es por lo que los metales conducen muy bien la electricidad, porque sus electrones de valencia al estar formando una nube al rededor de la estructura cristalina, no tienen problemas a la hora de desplazarse.
Ademas, al tener los átomos (cationes) muy juntos, obtenemos mas densidad, esa estructura tiene una gran cualidad, y es que como entre los cationes no hay electrones, estos se pueden juntar mas unos a otro, por lo que generan una estructura cristalina muy fuerte .
3) Características de los materiales metálicos
Los metales tienen algunas características propias, las cuales se las da su enlace, que como ya hemos visto es completamente distinto a los otros enlaces, pero otras características son propias de cada metal en si, es decir, el plomo comparte algunas características con el cromo, pero esta claro que cada una tiene las suyas propias, en el caso del plomo su característica propia es su densidad, y en el caso del cromo es su brillo y su resistencia a la corrosión. las cuales no tiene en tanta medida el plomo.
- Brillo metálico: reflejan bien la luz ya que los electrones forman una capa que refleja los fotones, este brillo es característico de todos
- Dureza: la dureza se la da el tipo de enlace, en el caso de los metales son poco duros, es decir, resisten mal a ser rayados, para mejorar esa cualidad, se suelen alear con otros metales o incluso con no metales para mejorar esta característica (también para mejorar otras, no solo con esta).
- Opacidad: Los metales son opacos, es decir, no se puede ver a través de ellos
- Efecto fotoeléctrico: Los metales pueden emitir electrones por excitación luminosa o por excitación térmica, la energía suministrada por cualquiera de estas fuentes es suficiente para que los electrones puedan vencer el campo eléctrico creado por los cationes de la red cristalina y escapar de su atracción
-Temperatura de fusión: La temperatura de fusión es generalmente alta (no en todos), en este apartado hay bastante disparidad, ya que algunos tienen temperaturas de fusión de 3000º C y en el caso del mercurio, se encuentra en estado liquido, por lo que podemos decir que a temperatura normal, casi todos están en estado solido.
- Densidad: la densidad de los metales es variable, los metales alcalinos son poco densos, mientras que los metales del centro de las series de transición tienen altas densidades, ya que el volumen atómico es menor en los átomos que tienen electrones d, esta variación esta de acuerdo con las energías de enlace.
- Ductilidad y maleabilidad: los metales son dúctiles, es decir, se pueden estirar en hilos y son maleables, se pueden obtener de ellos laminas muy finas, esto se debe a que los átomos, en la red metálica, están sometidos a fuerzas de igual intensidad en todas las direcciones y pueden sufrir desplazamientos sin que existan repulsiones electrostáticas
- Maleabilidad: es la capacidad que tiene los metales de formar laminas
- Oxidación: Todos los metales se oxidan, aunque de distinta forma y en tiempos distintos, es decir, en el caso del cobre se suele decir que no se oxida, y es mentira, ya que se oxida formando una película verdosa que le protege de seguir oxidándose mas.
En cuanto a lo que tardan en oxidarse, no tardan lo mismo en oxidarse un trozo de hierro, que de un día para otro su capa superficial se ha oxidado, que el cromo, el cual casi no se oxida ya que tarda mucho tiempo.
- Resistencia mecánica: Los metales resisten muy bien a los esfuerzos mecánicos (tracción, compresión, torsión y flexión), los aguantan sin romperse ni deformarse (VER: 4) Solicitaciones Mecánicas) , debido en gran parte a la siguiente característica que vamos a ver, que es su plasticidad.
-Plasticidad: son "bastante plásticos", lo que hace que se deformen antes de romperse
- Conductividad eléctrica y térmica: Todos los metales en mayor o menor medida son conductores de la electricidad, esto se debe, como ya dije, a que los electrones están en forma de nube sobre los átomos enlazados, por lo que apenas tienen fuerza sobre ellos que los una al núcleo y es muy fácil que la corriente eléctrica los haga moverse de un lado para otro.- Maleabilidad: es la capacidad que tiene los metales de formar laminas
- Oxidación: Todos los metales se oxidan, aunque de distinta forma y en tiempos distintos, es decir, en el caso del cobre se suele decir que no se oxida, y es mentira, ya que se oxida formando una película verdosa que le protege de seguir oxidándose mas.
En cuanto a lo que tardan en oxidarse, no tardan lo mismo en oxidarse un trozo de hierro, que de un día para otro su capa superficial se ha oxidado, que el cromo, el cual casi no se oxida ya que tarda mucho tiempo.
- Resistencia mecánica: Los metales resisten muy bien a los esfuerzos mecánicos (tracción, compresión, torsión y flexión), los aguantan sin romperse ni deformarse (VER: 4) Solicitaciones Mecánicas) , debido en gran parte a la siguiente característica que vamos a ver, que es su plasticidad.
-Plasticidad: son "bastante plásticos", lo que hace que se deformen antes de romperse
- Insolubilidad: Los metales en general son resistentes a disolverse en agua o en los disolventes normales (quizás algún tipo de disolvente especifico si pueda deshacerles)
4) Metalografía
La metalografia se encarga de estudiar la características estructurales de los distintos tipos de metales que hay, con todas sus aleaciones claro, gracias a esta ciencia podemos saber su conductividad, su fragilidad, su dureza... y todas las características, ya que dependiendo de la estructura cristalina (ordenada) que tengan las moléculas, los metales potenciara unas características u otras (por ejemplo, el cobre una estructura cristalina distinta al hierro, que le hace que sea mas dúctil).
Estructura microscópica de los metales
Los metales tienen una estructura de los átomos, es decir estos están distribuidos en el espacio de una forma definida, y no al azar.
Los átomos han de estar muy juntos, por lo que deben de aprovechar bien el espacio que tienen, y gracias a esto los metales tienen la densidad tan grande que les caracteriza.
Esta estructura que forman los átomos entre si se la llama estructura cristalina, y la unión de muchas de estas estructuras forman cristales, que se pueden unir entre si formando granos y la unión de muchos granos forma la pieza de metal que vemos a simple vista.
1) Grano
El grano de un metal no es otra cosa que la agrupación de cristales (las estructuras cristalinas que forman los átomos ordenados), estos cristales juntos forman granos, y estos granos a su vez también forman grupos con otros y forman una estructura granular, que es justo la que tienen los metales.
 |
| Estructura granular del acero vista al microscopio |
Este grano puede ser mas grande o mas pequeño, dependiendo del tamaño que tenga tendrá unas características u otras, normalmente es mejor que tengan un grano pequeño que uno grande; debido a que los metales que tienen el grano pequeño resisten mejor a la tracción, tienen mas dureza y se distorsionan menos durante el temple, por ultimo tienden a agrietarse menos que los de grano mas gordo, es por todo ello por lo que se suele utilizar en herramientas, como pueden ser cortafríos, cinceles, martillos, etc.
 |
| Distintos tamaños de grano |
Este grano en un metal no es siempre el mismo, lo que quiero decir es que podemos variar su tamaño aplicándole calor, a medida que aumentamos la temperatura, los granos del metal también aumentaran de tamaño.
¿Para que queremos nosotros variar el tamaño del grano de los metales? pues porque si cambiamos el tamaño del grano, también cambiaremos las propiedades mecánicas del material (resistencia a la tracción, a la compresión, a la flexión, etc) haciéndoles mejores para distintas aplicaciones, es por ello por lo que se templan los aceros, para cambiar el tamaño de sus granos, y así hacerle mas duro.
Existen varios tratamientos térmicos, como pueden ser el temple, el revenido, el recocido, el cimentado, etc, y todos ellos lo que buscan es cambiar el tamaño del grano para hacer adecuado el metal al uso que le queramos dar.
Un claro ejemplo del tratamiento térmico para cambiar los granos del metal y hacerle mas resistente es el cortafríos, el cual tiene la punta con los granos muy finos, sin embargo, en su cabeza (donde recibe los golpes) es de grano gordo, ¿como puede ser si esta hecho entero de una pieza? porque el filo le han sometido a un tratamiento térmico de templado para hacer que tenga un grano mas fino y así se deforme menos, ya que con la punta debe de cortar metal y no se nos puede deformar.
Mientras que la punta es muy resistente, la cabeza, que tiene una composición de grano mas grueso, es mucho mas deformable, si nos damos cuenta, todos los cortafríos a base de golpearlos con el martillo, les remachamos la cabeza que es donde recibe el golpe haciendo que el metal se expanda hacia todos los lados aumentando la superficie.
2) Cristal
Como ya dije, los átomos de un metal se agrupan entre ellos creando una estructura ordenada, a esta estructura ordenada la llamamos estructura cristalina, en ella los átomos tienen una forma de agrupación que se repite, es constante, si no fuera así, tendría una estructura amorfa, es decir, los átomos no tendrían un patrón de colocación, sino que tendrían una posición al azar en la estructura (como paradoja, el cristal, como el de una ventana, tiene una estructura de los átomos amorfa).
Cuando calentamos un cuerpo, ya sabemos que lo que pasa a nivel atómico es que sus átomos se mueven y se golpean entre si, por lo que van perdiendo sus enlaces, que son los que les mantienen en una estructura, por lo que el material se hace liquido, ya que los átomos no tienen ninguna fuerza que les una.
En el momento en el que ese liquido se enfría, pasa de tener una estructura indefinida (los líquidos no tienen forma) a una estructura cristalina, y eso se consigue ya que al disminuir la temperatura, los átomos se van dejando de moverse y empiezan a ocupar unos sitios fijos en el espacio, creándose la estructura cristalina y con ella que los átomos vuelva a enlazarse entre si con las fuerzas que les mantienen juntos.
A medida que se sigue enfriando y solidificando el metal, se van agrupando mas átomos formando una red cristalina y con ella un grano de metal, el cual se juntara a mas granos creando así un "todo" que seria el trozo de metal
3) Tipos de cristales más habituales;
Hay varios tipos de cristales en los metales, la forma de estos cristales es la que definirá en gran medida las características de un metal, como puede ser su densidad
Imaginemos una maleta, esta maleta se puede llenar con ropa arrugada y hecha una bola, o se puede llenar con ropa doblada y bien colocada. ¿en que caso de los dos pesara mas la maleta?¿en cual cabra mas ropa?
Las dos preguntas tienen fácil solución, con la ropa doblada entraran mas prendas y pesara mas la maleta, con los átomos es lo mismo, podemos juntarles de cualquier forma (estructura amorfa) y cabrán pocos átomos y como hay poca materia habrá también poca densidad, o podemos colocarlos (estructura cristalina) y entraran mas átomos y conseguiremos mayor densidad en la estructura
- Estructura Cubica Centrada en el Cuerpo:
También se la llama BCC, esta estructura de cristal tiene una forma tridimensional (de tres dimensiones) de cubo, este cubo del que hablo esta formado por 8 átomos (uno en cada vértice del cubo), estos átomos "envuelven" dentro de su estructura a otro que se encuentra en el centro geométrico del cubo que forman estos.
Esta estructura está formada por un átomo del metal en cada vértice de un cubo y otro átomo en el centro del cubo.
Los metales más comunes que cristalizan con esta estructura son el tungsteno, el cromo y el vanadio.
En esta estructura también hay que destacar que cada uno de los átomos está rodeado de otros 8 átomos
 |
| Estructura cubica centrada en el cuerpo |
Los metales que suelen tener este tipo de cristalización son el litio, el sodio o el potasio (una cosa curiosa es que todos ellos están en el primer grupo de la tabla periódica, uno debajo del otro)
- Estructura Cubica Centrada en las Caras:
Se la suele conocer por las siglas FCC, y se asemeja un poco a la anterior, ya que esta también tiene 8 átomos en cada vértice que forman un cubo, sin embargo, no tiene un átomo en el centro, sino que tiene uno en el centro de cada cara del cubo, es decir, 6 átomos mas
 |
| Estructura cubica centrada en las caras |
Los metales que están formados por esta estructura cristalina son entre otros el cobre, la plata, el platino, el oro, plomo y el níquel
(estos se encuentran en el grupo 10 y 11 de la tabla periódica, como vemos todos ellos son metales con bastante densidad, al tener mas átomos dentro de un mismo cubo que los BCC es normal que sean también mas densos, como podemos observar todas las cosas están relacionadas)
- Estructura Hexagonal Compacta:
Se la conoce también por el acrónimo HCP, los átomos en esta estructura, como su nombre nos indica, están en disposición hexagonal tridimensional en vez de la cubica que teníamos anteriormente.
Dentro de este prisma hexagonal los átomos que le forman, como en el cubo, se encuentran en sus vértices y ademas tiene 1 átomo en cada base y 3 mas que se encuentran en el centro del prisma
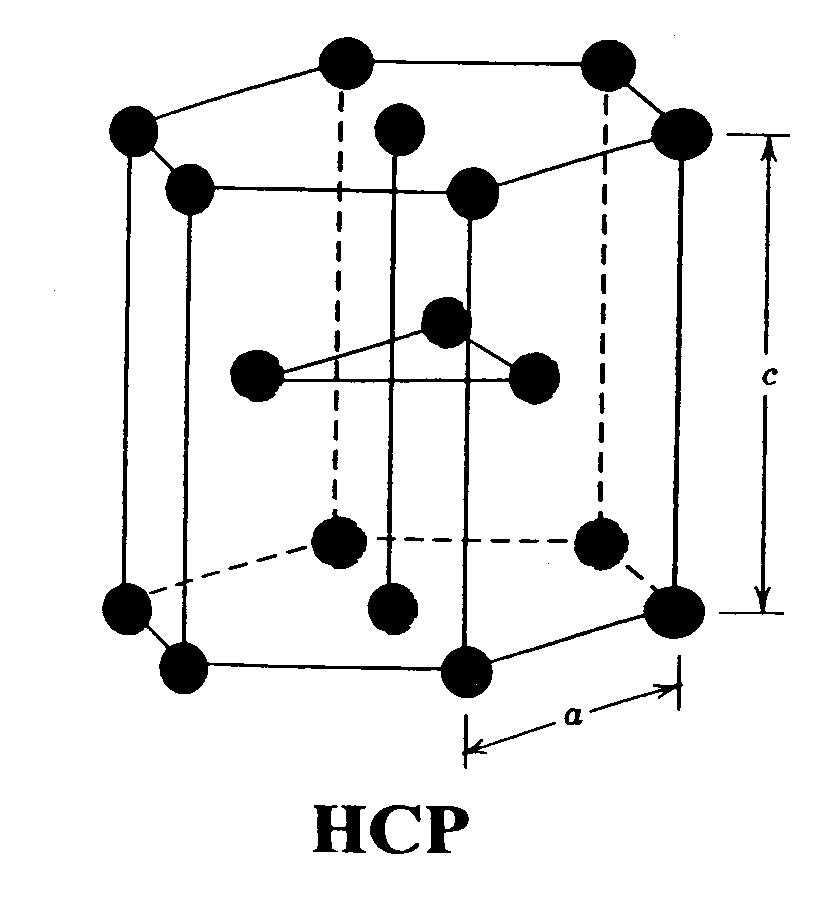 |
| Estructura hexagonal compacta |
5) Materiales metálicos:
Los metales se conocen desde la prehistoria, y fueron ellos los que nos hicieron evolucionar hasta lo que somos, ya que su utilización fue un gran avance evolutivo que incluso dio nombre a tres edades de los hombres, la del cobre, después la del bronces (cuando aprendieron a alearlo) y por ultimo la del hierro.
Sin duda los materiales hoy en día representan haya donde miremos, desde estructuras de edificios, pasando por todos los vehículos hasta llegar a un clip. todo en este mundo ha sido posible gracias a saber utilizar los metales, a saber alearlos, tratarlos, moldearlos y obtenerlos de la naturaleza.
Los metales en estado puro generalmente no los hay en la naturaleza, y mucho menos se emplean en los coches, ya que sus propiedades mecánicas son bastante justas, así que para alcanzar el nivel de dureza, elasticidad, resistencia, etc, necesitamos alearlos y someterlos a tratamientos térmicos para mejorar aun mas sus características.
Por ejemplo, para hacer un rodamiento, la base del rodamiento es el hierro, pero después se alea con carbono para hacer acero, y con otros materiales metálicos mas duros para aumentar su dureza y que aguanten bien la temperatura (como el molibdeno por ejemplo) y ademas se alea con metales duros y resistentes (como el cromo y el níquel) haciendo asi un acero especial para rodamientos, que luego ademas se le somete a un tratamiento térmico para mejorar mas ciertas cualidades.
Clasificación por densidad e importancia industrial;
Podemos clasificar los metales según su densidad, la densidad ni es otra cosa que la relacion que existe entre la masa de un cuerpo (lo que pesa) y el volumen que ocupa, los metales se caracterizan por ser elementos densos (ninguno de ellos flota en el agua), atendiendo a eso los podemos clasificar de menos a mas, siendo el que menos densidad tiene, que es el litio, el cual solo tiene 0,53 g/cm2 hasta el mas pesado que no es el plomo o el oro como todos pensamos, sino que es el Osmio el cual tiene 22,57 g/cm2.
 |
| Tabla con algunos metales y sus densidades |
Dependiendo de su uso industrial también los podemos clasificar, el mas utilizado es el acero (si hablamos de acero también de hierro), pero se deben de dividir en 2 grandes grupos, el primero es el grupo de los metales férricos (que son los derivados del hierro, como el acero) y los metales no férricos (que son todos aquellos que no contengan hierro)
Metales ferrosos:
El hierro:
Es el metal más usado, con el 90% en peso de la producción mundial de metal. El hierro puro no tiene demasiadas aplicaciones, pero si le aleamos con carbono y obtenemos acero de el, las aplicaciones son muchísimas
El acero es indispensable debido a su bajo precio y dureza, especialmente en coches (después hablare mas de el)
Ademas de el carbono (que es un no metal), con el hierro podemos alear metales como el magnesio, el cromo, el níquel, el cobalto, el molibdeno o el Wolframio (también conocido aquí como tungsteno):
Metales no ferrosos:
-Los pesados:
1-Estaño:
El estaño tiene una densidad mas o menos elevada, su punto de fusión alcanza los 231 ºC (es por eso por lo que se le utiliza en soldaduras blandas, ya que es muy fácil alcanzar esa temperatura con un soplete, o casi con cualquier llama).
También es muy blando y flexible, sin embargo al calentarlo es frágil y quebradizo
Aleaciones: las más importantes son el Bronce, que es de cobre y estaño
El acero es indispensable debido a su bajo precio y dureza, especialmente en coches (después hablare mas de el)
Ademas de el carbono (que es un no metal), con el hierro podemos alear metales como el magnesio, el cromo, el níquel, el cobalto, el molibdeno o el Wolframio (también conocido aquí como tungsteno):
Metales no ferrosos:
-Los pesados:
1-Estaño:
El estaño tiene una densidad mas o menos elevada, su punto de fusión alcanza los 231 ºC (es por eso por lo que se le utiliza en soldaduras blandas, ya que es muy fácil alcanzar esa temperatura con un soplete, o casi con cualquier llama).
También es muy blando y flexible, sin embargo al calentarlo es frágil y quebradizo
Aleaciones: las más importantes son el Bronce, que es de cobre y estaño
2-Cobre:
El cobre tiene un color característico, ya que es rojizo, su punto de fusión es de 1083 ºC; es dúctil, manejable y condice muy bien la electricidad y el calor (por eso se utiliza en cables eléctricos y en tuberías de agua)
Aleaciones: las más importantes son el bronce (cobre + estaño), latón que se compone de cobre y cinc.
Aplicaciones: campanas, engranes, cables eléctricos, motores eléctricos, etc.
El cobre tiene un color característico, ya que es rojizo, su punto de fusión es de 1083 ºC; es dúctil, manejable y condice muy bien la electricidad y el calor (por eso se utiliza en cables eléctricos y en tuberías de agua)
 |
| Cobre |
Aleaciones: las más importantes son el bronce (cobre + estaño), latón que se compone de cobre y cinc.
Aplicaciones: campanas, engranes, cables eléctricos, motores eléctricos, etc.
3-Cobalto:
El cobalto tiene un punto de fusión es de 1490 ºC;
Tiene propiedades parecidas a las del níquel, pero este no es magnético, se suele emplear para endurecer el acero para hacer herramientas con el (acero HSS o Hight Speed Steel, que ya hable algo de ele en la entrada de mecanizado básico) y también se utiliza para fabricar metales duros que se emplean otra vez para herramientas de corte sobretodo
El cobalto tiene un punto de fusión es de 1490 ºC;
Tiene propiedades parecidas a las del níquel, pero este no es magnético, se suele emplear para endurecer el acero para hacer herramientas con el (acero HSS o Hight Speed Steel, que ya hable algo de ele en la entrada de mecanizado básico) y también se utiliza para fabricar metales duros que se emplean otra vez para herramientas de corte sobretodo
Los ligeros:
1-Titanio:
1-Titanio:
El titanio tiene una densidad de 4.45 kg/dm3, por lo que se encuentra entre los metales ligeros, tiene un punto de fusión de 1800 °C.° y resiste muy bien a la tracción, se usa mucho en cirugía, en la cual se instalan prótesis de este material
2-Aluminio:
El aluminio también es otro metal de poca densidad, este tiene menos que el titanio, la cual es de 2,7 kg/dm3.
El aluminio se obtiene de la bauxita, que es como se llama al mineral que lo contiene, se funde a los 660º, pero aunque el punto de fusión sea bajo, es muy difícil soldarlo, es ligero (ya que tiene poca densidad) y se podría decir que "inoxidable" aunque esto no es del todo cierto, ya que tiene un oxido, que se llama oxido de aluminio que le sale en la capa exterior y le protege de seguir oxidándose (como el cobre).
Al igual que el cobre, el aluminio también conduce bien la electricidad y el calor (luego hablare mas sobre el)
 |
| Titanio |
2-Aluminio:
El aluminio también es otro metal de poca densidad, este tiene menos que el titanio, la cual es de 2,7 kg/dm3.
El aluminio se obtiene de la bauxita, que es como se llama al mineral que lo contiene, se funde a los 660º, pero aunque el punto de fusión sea bajo, es muy difícil soldarlo, es ligero (ya que tiene poca densidad) y se podría decir que "inoxidable" aunque esto no es del todo cierto, ya que tiene un oxido, que se llama oxido de aluminio que le sale en la capa exterior y le protege de seguir oxidándose (como el cobre).
Al igual que el cobre, el aluminio también conduce bien la electricidad y el calor (luego hablare mas sobre el)
Los ultraligeros:
1-Magnesio:
EL magnesio pesa muy poco, ya que tiene una densidad de 1,74 k/dm³, ademas de tener una pequeña densidad, también tiene un bajo punto de fusión, el magnesio se hace liquido a solo 650º C
El magnesio es de color blanco y tiene mas resistencia que el aluminio (aunque tenga menos densidad)
 |
| Magnesio |
Tiene una característica especial y es que en estado líquido y en polvo es muy inflamable
El Acero; (descubrimiento, procedencia minera-lógica del hierro, importancia histórica, características, propiedades más significativas, estructuras cristalográficas, colores del acero en función de la temperatura)
El acero es la aleación mas empleada en los vehículos, este es una aleación de hierro y carbono en una proporción de carbono de entre un 0,03% y un 01,67%, las propiedades que tiene el acero le hacen el ideal para ser el metal mas utilizado no solo en los coches, sino en el mundo entero (ya que representa el 80% de toda la industria del metal el solito), el único inconveniente que tiene es su peso y que se oxida muy fácil.
 |
| Barras de acero |
|
El aluminio es un metal, el cual es muy común en la tierra, de hecho se encuentra asta en la arcilla, pero no se encuentra como tal, sino que el aluminio se extrae de un mineral llamado bauxita, la cual hay que transformar en alúmina y después debemos de transformar esta en aluminio.
La bauxita se encuentra mucha en sudamerica, en la cual se extrae de las rocas que la contienem la extracción del aluminio a partir de las rocas que lo contenían se reveló como una tarea muy dura. A mediados de siglo, podían producirse pequeñas cantidades, reduciendo con sodio un cloruro mixto de aluminio y sodio.
| Bauxita |
La única pega por la que no se extrae todo el aluminio que se puede es por la gran cantidad de energía eléctrica que necesita para producirse, es por eso por lo que su uso en el mundo se ha retrasado tanto, porque antes se hacia muy caro conseguirle.
Pero lo bueno que tiene es que se puede reciclar indefinidamente y ademas sale mucho mas barato ya que se gasta en reciclarlo exactamente el 5% de la energía que se gasta en extraerle de la bauxita
El aluminio ha sido muy importante históricamente ya que la utilización del aluminio ha hecho de este metal uno de los más importantes, tanto en cantidad como en variedad de usos, siendo hoy un material polivalente, hoy en día, es el segundo mas utilizado en el mundo (el primero como ya sabemos es el acero) el aluminio se usa en forma pura, aleado con otros metales o en compuestos no metálicos, en estado puro se aprovechan sus propiedades ópticas para fabricar espejos domésticos e industriales, como pueden ser los de los telescopios reflectores, su uso más popular es como papel aluminio
Las características del aluminio son:
El aluminio es un metal ligero, con un bajo punto de fusión (660 °C). Su color es blanco y refleja bien la radiación electromagnética. Es buen conductor eléctrico y térmico. Se trata de un material blando y maleable, siendo adecuado para la fabricación de cables y laminas delgadas.
Las propiedades del aluminio son:
Tiene una baja densidad, alta resistencia a la corrosión y si se alea con otros metales se le puede aumentar la resistencia mecánica.
Su estructura cristalina se ordena en una red tridimensional cubica centrada en las caras.
 |
| Aluminio |
La estructura del aluminio tiene una característica que lo diferencia de los demás, y es que no varia con la temperatura, como pasaba con la de los otros metales, el aluminio se compone de una estructura cubica centrada en las caras (FCC), y por culpa de esta estructura es tan difícil soldar el aluminio, porque se mantiene en estado solido justo hasta su punto de fusión, en el que derrepente se hace liquido
Propiedades del aluminio
- Se trata de un metal ligero
- Es un material dúctil: se puede utilizar para fabricar cables
- Tiene una densidad baja (dentro de los metales
- La oxidación del aluminio es mu rápida, se recubre de una capa de oxido que le impide seguir oxidandose
- Con un bajo punto de fusión 660 °C
- Su color es blanco y refleja bien la radiación electromagnética del espectro visible y el térmico.
- Conduce bien la electricidad
- Un punto de ebullición alto, mas alto que el del acero, es de 2450 °C
- Es un material maleable
Para mejorar estas propiedades mecánicas se alea con otros elementos, normalmente se suele alear con el cobre, formando duraluminio, pero también se le alea con magnesio, manganeso, cobre, zinc y silicio, a veces se añade también titanio y cromo.
-----------------------------------------
Finaliza ya la entrada de los materiales metalicos, con ella hemos podido ver y mas o menos comprender como varia el compartamiento de un metal segun su estructura atomica interna, y como el calor y el enfriamiento de un metal nos puede variar sus caracteristicas segun nosotros queramos
Un saludo! ☺️
No hay comentarios:
Publicar un comentario